1. Financement de la recherche et résultats
Depuis 8 ans nous participons aux recherches du laboratoire INSERM de Bordeaux dirigées par le Pr de Verneuil et principalement à celles de l’équipe dermatologie du Pr A.Taïeb et le Dr Hamid Rezvani.
Ses recherches ont abouti à la découverte d’une molécule pour laquelle l’INSERM de Bordeaux a obtenu le label «médicament orphelin» et un brevet.
Cette molécule a montré un effet limitateur des cancers cutanés chez la souris et un effet antivieillissement des cellules.
- Projet essai clinique
La licence d’exploitation de cette molécule a été accordée à la société ProGeLife, située à Marseille, cofondée et dirigée par Christophe Hubert.
Cette société créée en 2006 a pour stratégie de lutter contre les maladies rares du vieillissement et certains cancers.
Ceci va permettre de promouvoir un essai clinique afin de prouver l’apport de cette molécule à nos enfants XPC.
Le médicament aura une forme de crème à appliquer sur la peau. Cet essai débutera certainement en 2018 après une longue période de démarches administratives qui vont impliquer plusieurs pays européens. Il faut en effet un nombre important de malades pour que l’essai soit validé.
L’Association est partie prenante de cet essai, chaque famille a reçu un questionnaire élaboré par le Dr Cécile Ged du CHU de Bordeaux.
Nous continuons de financer ce laboratoire qui va à présent tester cette molécule sur des souris ayant le gène XPA.
2. La thérapie génique
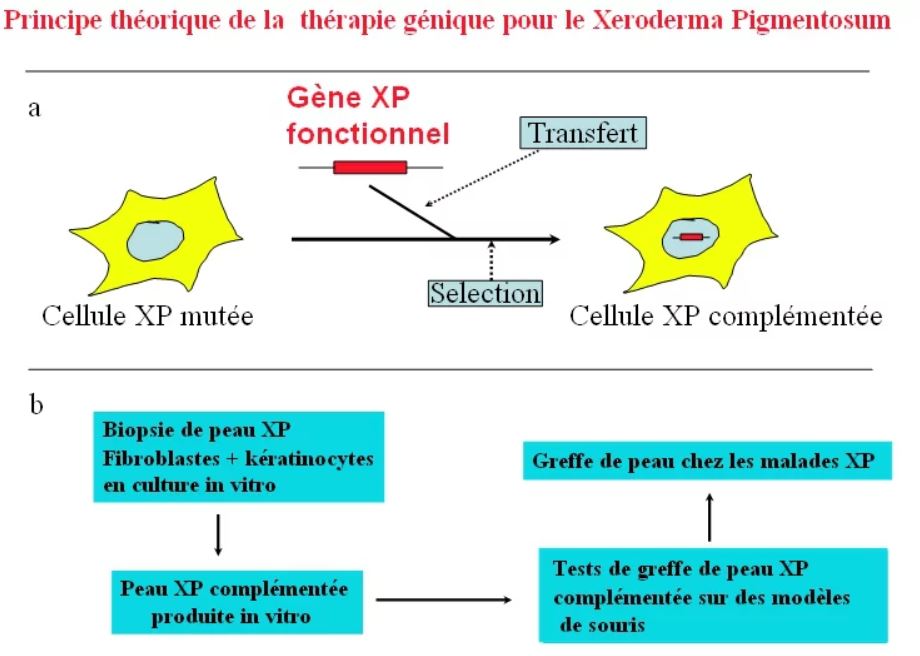
Le but de la thérapie génique est d’apporter à la cellule mutée isolée d’un malade le gène normal qu’elle aurait dû posséder.
Dans le cas du XP, le gène à apporter est l’un des 8 gènes du XP (XPA à XPG et XP variant). Les recherches actuelles se sont focalisé sur le gène XPC car ce groupe représente le plus grand nombre de malades XP et de plus les malades ne développent pas d’anomalies neurologiques.
L’introduction d’un gène dans une cellule déficiente est obtenue par l’utilisation de rétrovirus recombinants (sans danger chez l’homme) dans lesquels les chercheurs ont inséré le gène « fonctionnel » normal de réparation (Carreau et al., 1995, Human Gene Therapy, 6, 1307-1315).
Les rétrovirus sont des virus dont le matériel génétique est de l’ARN au lieu de l’ADN et sont responsables dans la nature de certaines maladies. Les virus recombinants pour la thérapie génique ont été sérieusement modifiés dans les laboratoires pour ne plus présenter de danger s’ils sont utilisés chez l’homme. Le rétrovirus infecte 90% des cellules in vitro et les cellules complémentées (celles qui sont redevenues normales du fait du bon fonctionnement du gène ajouté) sont ainsi sélectionnées et amplifiées.
Il a été possible à partir d’une petite biopsie de peau non exposée chez des malades XP de cultiver indépendamment les fibroblastes et les kératinocytes de la peau. À partir de ces cellules, on peut reconstituer de la peau XP in vitro possédant toutes les caractéristiques de la peau XP in vivo (Bernard et al., Proc. Natl. Acad. Sci., USA, 2001, 98, 7817-7822).
En utilisant les rétrovirus, on peut complémenter les cellules en culture XP et fabriquer de la peau reconstruite XP normale pour la sensibilité aux UV (Arnaudeau-Bégard et al., Human Gene Therapy, 2003, 14, 983-996). Cette peau modifiée et capable de résister aux UV a été greffée avec succès chez la souris. Après plusieurs mois de greffes chez la souris la peau humaine de XPC complémentée est toujours capable de réparer normalement son ADN (Warrick et al. Molecular Therapy, 2012, 20, 798-807).
Il faut attendre également l’apparition sur le marché de rétrovirus recombinants totalement dénués d’effets secondaires négatifs chez l’homme.
Dans ce domaine, chaque laboratoire est aussi dépendant des succès obtenus dans d’autres laboratoires dans le monde.
Une étude plus récente et originale vient d’être publiée par le groupe d’Alain Sarasin (CNRS, IGR, Villejuif) en collaboration avec une Société de Biotechnologie (Cellectis, Paris) et qui consiste, non pas à complémenter la cellule XP en y insérant un nouveau gène XP normal, mais en corrigeant la mutation initiale présente chez les malades et responsable de la maladie. Dans cette étude, la mutation spécifique des malades XP-C d’Afrique du Nord (une délétion de 2 bases TG au milieu du gène XPC) a été corrigée de façon à remettre juste la bonne séquence au bon endroit dans le gène sans toucher à d’autres endroits de l’ADN cellulaire. Cette technique est en principe la meilleure pour corriger les mutations et refabriquer des cellules normales à partir de cellules de malades XPC, sans conséquences délétères pour la survie des cellules. Par contre, son efficacité est actuellement trop faible pour être rapidement applicable chez l’homme (Dupuy et al, PLoS ONE, 2013, 8, e78678; Dupuy and Sarasin, Mutation Res. 2014, In Press).
De nombreux efforts sont encore à effectuer avant tout essai de greffe de peau chez un malade XP : déterminer pendant combien de temps ce gène ainsi introduit sera actif dans les cellules complémentées, test de greffes sur des animaux modèles, test d’innocuité chez l’homme.
De plus la partie culture de cellules de malades destinées à la greffe humaine doit être faite par des laboratoires privés spécialisés dans ce domaine. Les laboratoires de recherche académiques n’ont pas la possibilité technique de fabriquer ces peaux reconstruites greffables chez le malade.
Malheureusement, la route est encore longue avant un test grandeur nature chez les malades.